智通财经APP讯,香雪制药(300147)(300147.SZ)发布公告,公司孙公司香雪生命科学技术(广东)有限公司(简称“香雪生命科学”)收到了国家药品监督管理局签发的《药物临床试验批准通知书》(编号:2022LP00657),香雪生命科学于2022年1月向国家药品监督管理局提交的TAEST1901注射液新药临床注册申请已获得临床试验许可。
据悉,TAEST1901注射液是HLA-A*02:01/AFP特异性的亲和力增强的TCR-T治疗产品,针对的靶点是HLA-A*02:01及AFP抗原肽组成的复合物,使用慢病毒转导自体T细胞,表达AFP抗原特异性的TCR。通过系统的临床前研究,TAEST1901注射液在安全特性上显示了良好的安全性;在有效性上,TAEST1901在体内/外针对HLA-A*02:01和AFP双阳性的靶细胞具有良好的特异性药效。
推荐内容
-

地产并购融资放松 首单房地产项目并购主题债券启动发行
-

贷款市场报价利率迎来调整 深圳房贷市场应声下调
-

央行下调LPR 新一期贷款市场报价利率(LPR)出炉
-

二级市场提振 复星医药、博瑞医药等相关个股大涨
-

消费股成为公募基金增持的主要方向 泸州老窖、贵州茅台获增持最多
-

家政服务企业保障人员供应 价格没有出现大的波动
-

多个城市培育建设国际消费中心城市 打造商业新增长极
-

春节外卖服务保供应 多措并举激励骑手留京过年
-

保险机构扩容潮逐渐消退 保险公司股权监管进一步强化
-

我国白开水赛道进一步扩大 农夫山泉加入战局
-

基本民生商品进入消费旺季 进一步抓实抓细市场保供
-

“隔离险”保费仅需9.9元 隔离1天补贴1000元可信吗?
-

知名啤酒厂商推出高端产品 上千元的啤酒你会买吗?
-

地方和企业抓住RCEP机遇 推动制造业和高端服务业融合发展
-

全年累计新增减税降费约1.1万亿元 政策红利持续释放
-

渝中区建立成渝地区双城经济圈 围绕国际一流营商环境打造
-

中国奢侈品消费潜力不断释放 海南免税购物进一步推动奢侈品消费
-

春节档票房逐年上升 11部影片“激战”2022年春节档
-

春节旅游消费依然呈现本地化 自驾游成主流出行方式
-

虎年金条热起来 一线城市的黄金饰品需求旺盛
-

董明珠新任期内提升空调业务效率 寻找格力第二增长曲线
-
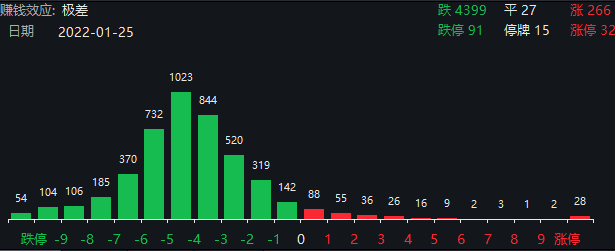
白酒概念、元宇宙、冰雪产业等多数概念股走弱
-

第三支柱个人养老金作为改革重点 持续创新商业模式
-

途虎养车年收入近年来不断攀升 16轮融资后开启IPO
-

韩国“菜篮子物价”创十年新高 食品类价格明显比往年高
-

多举措加强重点领域信用监管 依法依规实施联合惩戒
-

多地重大项目集中开工 投资规模力度明显加大
-

海南自贸港原辅料“零关税”增补清单落地 政策效应进一步扩大
-

消费重回经济增长第一动力地位 持续激发线上消费新活力
-

软件业务出口保持增长 从业人员规模不断扩大
-

北向资金持续看好 沪深两市成交额11290亿元
-

新一期贷款市场报价利率(LPR)公布 有助于提振房地产市场
-

睿远两基金仓位变化不大 持股以长期投资逻辑为主
-
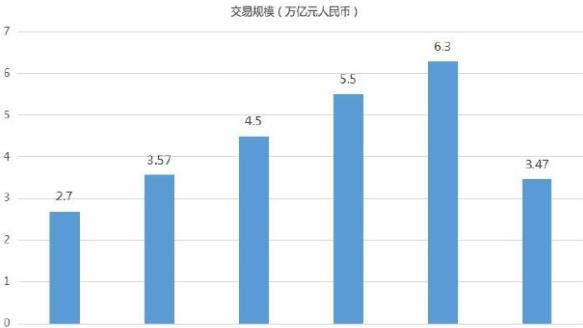
沪深两市低开震荡 收盘双双出现小幅回调
-

孩子王线下、线上面临经营困局 2021年业绩出现大幅下滑
-

国际油价创七年新高 期货价格18日收盘时均显著上涨
-

“食物银行”启用后即显萧条 引导更多餐饮企业和生鲜食品企业参与
-

新型冠状病毒核酸检测项目统一定价收费 不得收取“加急费”
-

到2025年地理标志认定数量保持稳定合理增长
-

冰雪旅游成为众多目的地冬季消费的新动能 南方的冰雪场馆越来越多
-

33家保险公司发布年度理赔报告 头部险企的总赔付金额有所增长
-

2021年末社会融资规模存量为314.13万亿元 同比增长10.3%
-

2022年物价或将延续温和上涨态势 仍将处在合理区间
-

新年要有仪式感 多品牌推出虎年限定款式
-

互联网保险新规落地 万能险、分红险成为历史
-

中石油、中石化、中海油三大公司组织好成品油生产
-

税务部门高效落实减税降费政策 为食品产业链发展添力
-

西宁综保区建成运行正式封关运行 构建双循环新发展格局
-

餐饮企业改进预订年夜饭的方式 半成品、预制菜成为“新宠”
-

植物奶市场近两年发展快速 即杏宣布完成千万元天使轮融资
-
租壳的谎言
-
建筑:一季度基建投资跳升超预期,央国企业绩逐季加速性价比高
-

养老理财试点扩围 养老理财试点产品运作模式更为灵活
-
员工被物理殴打!美的集团发函通知全品类撤出济南国美
-
ST宏图:ST宏图关于独立董事任期届满辞职暨补选独立董事的公告
-
光大证券(06178.HK):闫峻辞任董事长,刘济平辞任监事长职务
-

黄酒市场区域色彩浓 积极向全国化市场拓展
-
光大证券(06178):闫峻辞任公司董事长
-
盘前必读:交通运输部截至4月18日全国高速公路收费站临时关闭116个
-
富吉瑞:关于监事辞职及补选监事的公告
-
锂电未来趋势:电车赛道维持高景气,锂电池产业链变革也将不断加速
-
ST柏龙:广东柏堡龙股份有限公司关于公司董事、监事及高级管理人员辞职的公告
-

儿童食品质量参差不齐 未来该如何规范与监管?
-
步步高怎能借回购之名炒自家股票
-
2021年各季度净利润及现金流量净额差异较大引关注 *ST乐材(300446.SZ)收深交所问询函
-
三柏硕实控人间接控股71% 海外收入占比逾九成面临多重不确定性
-
香雪制药(300147.SZ):TCR-T治疗产品TAEST1901注射液获得药物临床试验许可
-
券商包销浮亏6853万 经纬恒润“开局不利”
-
光大证券(601788.SH):董事长闫峻因工作调整辞职
-
广电网络:关于高级管理人员辞职的公告
-
合景泰富:行业分化下服务型房企迎发展契机
-
环京楼市新动向:多地房贷利率松动 张家口首套房首付比例降至20%
-
加强数字政府建设 打造智慧便捷数字化服务体系
-

招商银行大跌9%以上 央行降准不及预期
-
佐力药业:关于公司副总经理兼董事会秘书辞职的公告
-
中信证券:比亚迪汽车业务业绩压力最大的时点已过 后续净利润将逐季向好
-
犀牛早报:1165只私募基金发出净值预警 4月份已有超六成新股破发
-

市场热点快速切换 农林牧渔板块表现出较好的持续性
-
物企银城生活服务净利率排倒数,老板却忙着给高管发“红包”
-
谷雨 | 二十四节气
-
水产预制菜主要食材价格创历史新高 两家产业链公司受益产业价值不断做大
-
北京科锐:关于公司副总经理、财务总监辞职的公告
-
悲观者可能正确,但只有乐观者才能成功!
-

四川七大举措打造民营企业雁阵 建立完善现代企业制度
-
紫金矿业:与仙乐都矿业签署股权认购协议
-
粉笔科技业绩转亏裁员过冬 协议班能“吸粉”但退费率存疑云
-
百瑞赢内参:极度缩量之后会是变盘吗?
-
香雪制药(300147.SZ):TAEST1901注射液获批临床试验
-
安信证券:4月快递物流行业持续复苏 行业拐点已现
-

一季度四川省经济延续恢复增长态势 农业生产形势良好
-
赛生药业(06600.HK):国家药监局受理DANYELZA? (那西妥单抗)及GM-CSF联合伊立替康及替莫唑胺用于原发难治性或首次复发高危神经母细胞瘤患者的IND
-
光大证券(601788.SH):闫峻辞去公司董事长职务
-
干货!熊市下如何做到高成功率和大赢小损?方法技巧很重要
-
天风证券:地产政策持续加码 坚定看好家居龙头
-
宏昌电子:宏昌电子关于公司非独立董事辞职及补选董事的公告
-
赛诺医疗:赛诺医疗科学技术股份有限公司关于职工监事辞职及补选职工监事的公告
-
经济日报:发挥稳楼市在稳大盘中作用
-
以岭药业止跌转涨 龙虎榜显示机构在卖出
-
纳指大涨2.2%!股市为何在收益率飙升情况下还能反弹?
-
暴涨近120%后,竟是个假概念,公司刚刚澄清:未达成新冠口服药相关协议!两大铜矿停产,供应锐减,绩优概念股一览
-
早间公告:香雪制药TAEST1901注射液获药物临床试验许可
-
奈飞(NFLX.US)Q1用户十年来首次出现流失 盘后股价暴跌逾25%
-
美股飞舞,缺乏人气的市场,这些热点要注意
-
经济日报:发挥稳楼市在稳大盘中作用
-
美国天然气价格年内已翻番 机构称受基本面强劲驱动
-
康龙化成(03759)建议授出发行额外H股股份的可转换债券相关特别授权
-
盛屯矿业:在产的银鑫矿业铜钨锡多金属矿含有锡金属 锡作为伴生金属采选产能产量相对较小
-
IBM(IBM.US)Q1营收142亿美元同比增7.7% 混合云业务超预期
-
方大炭素筹划境外发行GDR并在瑞士证交所上市
-
破发弃购,券商压力山大!新股市场化博弈加剧,倒逼投行精准定价,打新投资者"结构调整"进行中
-
日经225指数开盘涨0.88%
-
光大证券:董事长、监事长辞职 目前其他高管人员未有变化
-
智通A股龙虎榜统计|4月19日
-
输配电及控制设备生产商江苏华辰(603097.SH)拟首次公开发行4000万股
-
两大铜矿停产 供应锐减 绩优概念股一览(附名单)
-
唐人神:一季度实现生猪出栏38.34万头
-
A股历次回购热潮启示:低估值才是王道
-
中国海洋石油(00883)已完成人民币股份发行
-
*ST大唐4月21日起“摘星脱帽”
-
中国海洋石油(00883.HK)委任武小楠为董事会秘书
-
老板电器:去年净利润13.32亿元 同比减少19.81%
-
4月份已有超六成新股破发 机构浮亏求市场化变局
-
低价股扩容 部分热门题材股表现强势
-
美股三大股指全线收涨 纳指涨逾2%
-
中国海洋石油(00883)委任武小楠为董事会秘书
-
荣盛发展业绩变脸 深交所急发关注函
-
汉邦高科:2021年度净利润约-7.54亿元
-
吉宏股份推出限量款数字酱酒
-
上汽临港乘用车工厂复工后首台车下线 周二开始单班生产
-
仲景食品:公司在2022年每周日CCTV-1《新闻联播》前、每周五CCTV-2《回家吃饭》中投放广告
-
逾530家公司预告一季度业绩 超七成预喜
-
一季度全国工程基建升温 西部基建投资增速明显
-
科兴制药上市净利连降2年去年扣非降66% IPO募资11亿
-
永悦科技:2021年度净利润约643万元 同比增加2.83%
-
成交额连日跌破8000亿元 A股又现缩量运行
-
市值不达500亿切腹谢罪!诺德股份副总博眼球式推票不可取
-
阳光电源2021年净利同比下滑19% 储能业务呈几何级增长
-
新鲜出炉!西藏珠峰:2022年第一季度净利润约8149万元 同比下降60.06%
-
A股公司百亿级投资频出 新能源新材料炙手可热
-
西藏珠峰:2021年净利润7.2亿元 同比增2255.61%
-
卓航控股(01865)拟与中北颐安合作成立合资公司从事贵金属业务
-
晚间市场出现两大利好
-
卓航控股(01865.HK)拟与中北颐安成立合资公司
-
ST起步:公司股东张晓双由于资金仍在筹措中,故暂未支付剩余股权转让款
-
翼辰实业(01596.HK):建议委任王福聚担任独立非执行董事
-
英特集团:2021年度净利润约1.68亿元 同比增加7.06%
-
收购事项未明股价先行涨停 银座股份否认消息泄露
-
内斗或致年报难产 海伦哲恐被实施退市风险警示
-
数字货币概念股神思电子拟易主 地方国企济南能源环保欲接盘
-
物业早餐丨2022年4月20日 星期三
-
百亿级私募一季度持仓浮出水面 看好困境反转机会
-
新鲜出炉!南京高科:2022年第一季度净利润约6.69亿元 同比增长20.86%
-
逾530家公司预告一季度业绩 超七成预喜
-
天元股份:预计2022年一季度业绩净利润0万~100万元
-
中国心连心化肥(01866)拟先旧后新配售5650万股 最多净筹3.59亿港元
-
中国心连心化肥(01866.HK)订立配售及认购协议 总筹3.67亿港元
-
农发种业龙虎榜:上榜营业部净买入近2000万元
-
冠捷科技:新工投及其一致行动人南京机电共减持公司股份约8990万股
-
*ST大唐:撤销退市风险警示和其他风险警示
-
盘后机会挖掘汇总:步步高上演“地天板”!食品饮料板块活跃 安记食品三连板!
-
老周侃股:步步高怎能借回购之名炒自家股票
-
宠物经济消费者调研:近六成受访养宠人群养狗
-
瞄准高端场景蓝海市场 卡萨帝与苏宁易购“1+1>2”
-
首开股份:千亿大厦遇利润迷局
-
中远海发(02866.HK)将于4月29日举行董事会会议以审批一季度业绩
-
开普检测(003008.SZ):许昌投资集团拟受让公司第一大股东开普电气100%股权
-
浙江新能(600032.SH)发布2021年业绩,净利润4.55亿元,同比增长60.35%,拟10派0.45元
-
美股纳指涨幅扩大至2%
-
科大讯飞双总部落户长沙 用人工智能助力“强省会”战略发展
-
CTR HOLDINGS(01416)发布2021年中期业绩 净利224万新元 扭亏为盈
-
CTR HOLDINGS(01416.HK)中期扭亏为盈至224万新元
-
百家淘客(08287)收到Absolute Skill Holdings Limited提出的呈请 正就呈请寻求法律意见
-
申达股份4月19日龙虎榜数据
-
华远地产:2021年归属股东净亏损6.69亿元 同比降261.68%
-
新湖中宝:公司2021年年度报告将于4月30日披露
-
华远地产去年营收近137亿 归属股东净利亏损约7亿
-
零售消费行业数据:65.6%网民偏好纯棉材质睡衣
-
国电科环(01296):合并协议前提条件尚未达成
-
浙江力诺:公司预计2022年第一季度归属于上市公司股东的净利润同比增长28.90 %到36.06%
-
北京银行的钱 没能走到京医通?
-
俄铝(00486.HK):黄宝莹辞任公司秘书
-
西藏珠峰(600338.SH)发布2021年业绩 净利润7.2亿元 同比增2255.61%
-
黄宝莹辞任俄铝(00486)公司秘书及授权代表
-
刚刚发布!俄乌冲突引发持续担忧,IMF最新报告调降全球经济增长预期
-
华阳新材(600281.SH)发布2021年业绩,净利润亏损4472.52万元,同比下降207.51%
-
药石科技:预计投入项目将产生收入10.08亿元
-
建霖家居(603408.SH)拟斥3000万至6000万元回购股份 回购价不超18元/股
-
周鸿祎发内部信称“数字安全元年到来” 360将全面转型
-
植华集团(01842.HK):集团连同其他获选供应商获潜在客户邀请就其软储存类货品进行的产品线审阅递交建议书
-
新锐股份(688257.SH)发布2021年业绩,净利润1.36亿元,同比增长19.66%,每10股派5元
-
金评天下:从利润和分红看 招商银行的大幅杀跌不合理
-
核心高管人均“红包”300万!老白干酒股权激励计划让股民很“上头”
-
奥海科技(002993.SZ)发布一季度业绩,净利润1.05亿元,同比增长26.99%
-
均瑶健康(605388.SH)发布2021年业绩,净利润1.47亿元,同比减少31.26%,每10股派2.2元
-
杭萧钢构(600477.SH)选举靳佳佳为职工代表监事
-
嘉戎技术(301148.SZ)将于4月21日在创业板上市
-
北京燃气蓝天(06828):业务营运均照常进行 继续停牌
-
国力股份(688103.SH)发布2021年业绩,净利润7300.38万元,下降47.23%
-
旋极信息:2021年度净利润亏损约1.13亿元
-
四指标锁定93只潜在现金奶牛 分红方案中寻觅新“升”机
-
扬农化工、润丰股份、安道麦……谁是成长能力最强的农药企业?
-
方大炭素拟筹划境外发行全球存托凭证并在瑞士上市
-
500亿锂电负极龙头增资30亿引入比亚迪和宁德时代 何时“扳倒”龙一贝特瑞?
-
杭萧钢构:2021年度净利润约4.12亿元 同比下降43.14%
-
中国金茂(00817)与中化保理订立新框架协议
-
隔夜外盘:美股三大指数全线收涨 纳指涨超2% 国际油价跌超5%
-
安科生物回复深交所关注函 坦言生产mRNA疫苗没经验没许可
-
*ST香梨(600506.SH)申请撤销对公司股票实施退市风险警示
-
奥海科技(002993.SZ)2021年度计提减值准备合计3921.22万元
-
全面教育行业数据:预计2023年中国音乐教育学前儿童市场规模达到760亿元
-
供应偏紧鸡蛋淡季不淡 业内人士:高价鸡蛋或成二季度常态
-
禾川科技(688320.SH)回拨后网上发行最终中签率约为0.0395%
-
澳洲充电桩制造商牵手能源巨头BP 共同打造电动车充电网络
-
*ST香梨(600506.SH)发布2021年业绩 净亏损3593.34万元 同比由盈转亏
-
北京燃气蓝天(06828)发布2021年业绩,股东应占亏损2.75亿港元,同比收窄92.6%
-
消息称埃隆·马斯克愿意投入100亿-150亿美元的自有现金来竞购推特
-
景业智能(688290.SH)回拨后网上发行最终中签率约为0.0382%
-
新锐股份(688257.SH)拟4541.12万元收购虹锐咨询100%股权
-
中一科技(301150.SZ)将于4月21日在创业板上市
-
500亿锂电负极龙头增资30亿引入比亚迪和宁德时代 何时“扳倒”龙一贝特瑞?
-
江苏阳光再战光伏:多次败北只会割韭菜 借新还旧资金隐忧大
-
上海三一已复工 预计本周恢复正常
-
保障性住房供给放量,远大住工迎接市场新机遇
-
植华集团(01842):获潜在客户邀请就其软储存类货品进行的产品线审阅递交建议书
-
远东控股国际(00036)出售807万股恒大新能源汽车股份及3000万股拉近网娱股份 套现3810万港元
-
远东控股国际(00036.HK):累计3810万港元出售上市证券
-
又莫名大跌!怎么办?
-
成绩单!长虹美菱:2022年第一季度净利润约515万元 同比下降2.83%
-
融捷股份:成都融捷锂业一期锂盐项目目前处于试生产阶段
-
发改委称将继续压减全国粗钢产量 市场预计原料承压 、钢企盈利或有改善
-
天康生物:天康食品成功入驻国铁商城
-
以岭药业2年股价翻5倍 连花清瘟争议挑战后期走势
-
方大炭素筹划境外发行GDR并在瑞士证交所上市
-
西藏珠峰:截至本公告披露日 公司及其控股子公司对外担保总额为1.63亿元
-
奥士康:2021年度净利润约4.9亿元 同比增加40.35%
-
杭州柯林2021年净利同比下降5% 拟10派15元
-
风险!杰美特:2022年第一季度净利润约-908万元
-
多氟多一季度净利润同比增长685.06%
-
新力金融:公司属于类金融行业,目前国内疫情对公司的业务影响较小
-
中国心连心化肥(01866)正计划进行补足股份配售 执行董事闫蕴华拟出售若干减持股份
-
山东黄金(01787.HK)一季度由亏转盈3.15亿元
-
奥海科技(002993.SZ)发布2021年业绩,净利润3.44亿元,同比增长4.4%,拟10派2元
-
新锐股份:2021年度净利润约1.36亿元 同比增加19.66%
-
亚太股份2021年净利增长168.37% 汽车电子业务加速突破
-
澄清未与真实生物达成协议!新冠口服药概念股拿下7天4板,“散户大本营”追高
-
丝路物流控股(00988)附属拟100万元收购内蒙古亚欧大陆桥物流23.396%股权
-
盟科药业科创板IPO注册阶段获问询 要求说明股东增资与相关资助情况
-
甘咨询(000779.SZ)发布2021年业绩,净利润3.27亿元,同比增长6.39%,拟10派1.5元
-
地铁设计:致力发展成为卓越的城市轨道交通一体化技术服务产业集团
-
国内商品期货夜盘多数收跌
























































