智通财经APP讯,基石药业-B(02616)发布公告,《新英格兰医学杂志》发表了拓舒沃?(艾伏尼布片)AGILE III期临床研究结果。AGILE研究是一项全球 III期、多中心、双盲、随机、安慰剂对照的临床试验,旨在评估拓舒沃?联合阿扎胞苷相较于安慰剂联合阿扎胞苷在先前未经治疗的异柠檬酸脱氢酶-1(IDH1)突变急性髓系白血病(AML)患者中的疗效和安全性。AGILE研究达到了主要研究终点和包括总生存期(OS)在内的所有关键次要终点。施维雅公司正在积极与包括美国食品药品监督管理局(FDA)在内的多个国家和地区的药品监督管理部门就拓舒沃?该新适应症上市申请展开沟通。基石药业计划在中国递交拓舒沃?该适应症的新药上市申请。
据悉,AML是一种进展迅速的血液和骨髓癌症,是成人白血病中最常见的类型。在美国,每年约有2万例新发病例。在中国,每年约有7.53万白血病新发病例,其中AML患者的占比约为59%。大多数AML患者最终会复发。复发或难治性AML患者的预后通常较差。患者五年生存率约29.5%。在被诊断为急性髓细胞白血病的患者中,约6~10%携带IDH1突变。
基石药业首席医学官杨建新博士表示:“我们非常高兴地看到AGILE III期AML研究优异数据在《新英格兰医学杂志》发表,这充分彰显了全球权威学术期刊对该研究结果和学术价值的高度认可。IDH1突变AML患者的预后差,尤其是IDH1突变的未经强化化疗的初治AML患者。拓舒沃?联合阿扎胞苷疗法将有望为这部分患者带来新的治疗选择。我们计划与中国国家药品监督管理局(NMPA)展开沟通,期待尽快将这一创新疗法带给更多中国患者。”
全球III期AGILE研究数据显示,与阿扎胞苷联合安慰剂相比,拓舒沃?是首个证实了与阿扎胞苷联用可提高患者EFS和OS的靶向疗法。拓舒沃?与阿扎胞苷联合治疗患者的EFS获得统计学意义的改善(风险比[HR]=0.33,[95% CI:0.16,0.69],单侧P值=0.0011)。拓舒沃?联合阿扎胞苷治疗组患者的OS同样获得具有统计学意义的改善(HR=0.44,[95% CI:0.27,0.73],单侧P值=0.0005),中位OS为24.0个月,安慰剂联合阿扎胞苷组为7.9个月。
此外,拓舒沃?联合阿扎胞苷的CR率为47.2%(n=34/72),而安慰剂联合阿扎胞苷为14.9%(n=11/74)(P
2019年7月19日,基石药业宣布全球 III期註册试验AGILE在中国完成首例患者给药。中国共有16家研究中心参与了AGILE研究。
拓舒沃?所属权为施维雅所有。根据和施维雅达成的独家授权授权合约,基石药业就拓舒沃?在包括中国大陆、中国香港、中国台湾及中国澳门地区在内的大中华地区以及新加坡地区进行临床开发与商业化。目前,NMPA已批准拓舒沃?(艾伏尼布片)的新药上市申请(新药上市申请),用于治疗携带IDH1易感突变的成人复发或难治性AML(R/RAML)患者。
推荐内容
-

地产并购融资放松 首单房地产项目并购主题债券启动发行
-

贷款市场报价利率迎来调整 深圳房贷市场应声下调
-

央行下调LPR 新一期贷款市场报价利率(LPR)出炉
-

二级市场提振 复星医药、博瑞医药等相关个股大涨
-

消费股成为公募基金增持的主要方向 泸州老窖、贵州茅台获增持最多
-

家政服务企业保障人员供应 价格没有出现大的波动
-

多个城市培育建设国际消费中心城市 打造商业新增长极
-

春节外卖服务保供应 多措并举激励骑手留京过年
-

保险机构扩容潮逐渐消退 保险公司股权监管进一步强化
-

我国白开水赛道进一步扩大 农夫山泉加入战局
-

基本民生商品进入消费旺季 进一步抓实抓细市场保供
-

“隔离险”保费仅需9.9元 隔离1天补贴1000元可信吗?
-

知名啤酒厂商推出高端产品 上千元的啤酒你会买吗?
-

地方和企业抓住RCEP机遇 推动制造业和高端服务业融合发展
-

全年累计新增减税降费约1.1万亿元 政策红利持续释放
-

渝中区建立成渝地区双城经济圈 围绕国际一流营商环境打造
-

中国奢侈品消费潜力不断释放 海南免税购物进一步推动奢侈品消费
-

春节档票房逐年上升 11部影片“激战”2022年春节档
-

春节旅游消费依然呈现本地化 自驾游成主流出行方式
-

虎年金条热起来 一线城市的黄金饰品需求旺盛
-

董明珠新任期内提升空调业务效率 寻找格力第二增长曲线
-
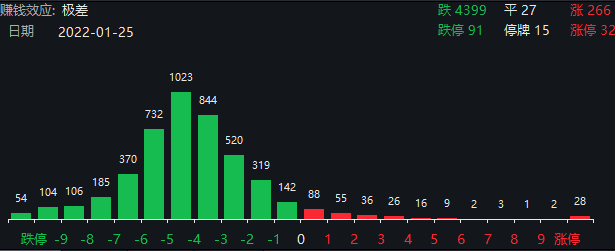
白酒概念、元宇宙、冰雪产业等多数概念股走弱
-

第三支柱个人养老金作为改革重点 持续创新商业模式
-

途虎养车年收入近年来不断攀升 16轮融资后开启IPO
-

韩国“菜篮子物价”创十年新高 食品类价格明显比往年高
-

多举措加强重点领域信用监管 依法依规实施联合惩戒
-

多地重大项目集中开工 投资规模力度明显加大
-

海南自贸港原辅料“零关税”增补清单落地 政策效应进一步扩大
-

消费重回经济增长第一动力地位 持续激发线上消费新活力
-

软件业务出口保持增长 从业人员规模不断扩大
-

北向资金持续看好 沪深两市成交额11290亿元
-

新一期贷款市场报价利率(LPR)公布 有助于提振房地产市场
-

睿远两基金仓位变化不大 持股以长期投资逻辑为主
-
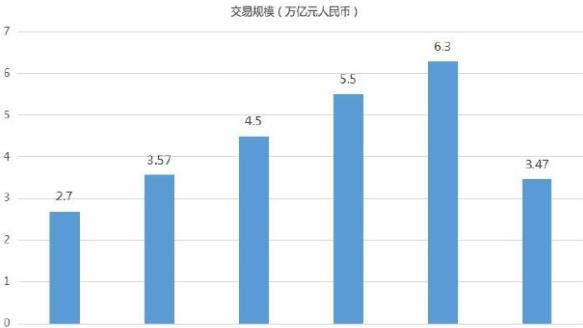
沪深两市低开震荡 收盘双双出现小幅回调
-

孩子王线下、线上面临经营困局 2021年业绩出现大幅下滑
-

国际油价创七年新高 期货价格18日收盘时均显著上涨
-

“食物银行”启用后即显萧条 引导更多餐饮企业和生鲜食品企业参与
-

新型冠状病毒核酸检测项目统一定价收费 不得收取“加急费”
-

到2025年地理标志认定数量保持稳定合理增长
-

冰雪旅游成为众多目的地冬季消费的新动能 南方的冰雪场馆越来越多
-

33家保险公司发布年度理赔报告 头部险企的总赔付金额有所增长
-

2021年末社会融资规模存量为314.13万亿元 同比增长10.3%
-

2022年物价或将延续温和上涨态势 仍将处在合理区间
-

新年要有仪式感 多品牌推出虎年限定款式
-

互联网保险新规落地 万能险、分红险成为历史
-

中石油、中石化、中海油三大公司组织好成品油生产
-

税务部门高效落实减税降费政策 为食品产业链发展添力
-

西宁综保区建成运行正式封关运行 构建双循环新发展格局
-

餐饮企业改进预订年夜饭的方式 半成品、预制菜成为“新宠”
-

植物奶市场近两年发展快速 即杏宣布完成千万元天使轮融资
-
基石药业-B(02616):《新英格兰医学杂志》重磅发表拓舒沃?AGILE III期临床研究结果
-

短剧成内容时代新宠儿 不到3分钟的剧情成为新形势
-
“自动化”下的国产替代机遇:重点关注伺服、传感/仪表、CNC和减速器等领域优质公司
-
“迷你房企”组团冲港股,救急还是救命?
-

四川92家国家级专精特新“小巨人”企业申报名单出炉
-

多家保险机构布局新市民金融服务 加大保险产品创新力度
-
弈樊说:左侧第一仓买入
-
要恢复人气,券商、赛道股得先止跌
-
商务部推动加快新型消费发展壮大 消费市场增长新动力
-

沪指小幅低开后短暂翻红 3100点整数关口被轻松击穿
-

四川出台14条政策措施助力工业经济稳定增长
-
干货,短线如何看卖点?一看就会,无私奉献
-
今日策略:散户,要学会通过风险较小的套利方式追逐利润
-

资本市场深化改革 保障养老金投资运作安全规范
-

规范发展第三支柱养老保险 实现养老保险补充功能
-
*ST大集:公司旗下各商超门店一直在开展社区团购
-
和胜股份更正2021年度利润分配预案
-
机构评级忙 智能座舱龙头最受关注 22股机构看涨空间高(附名单)
-
交易异动!华联股份:近3个交易日下跌24.8%,无未披露的重大信息
-
领地控股的去化之痛,可能才刚刚开始
-
舍得酒业拟投资70.54亿元扩产 持续推进老酒战略
-
游资踩上大雷,5连板牛股突发利空,业绩大跌近八成,股市下跌理财亏损!机构评级忙,智能座舱龙头最受关注,22股机构看涨空间高
-
蓝焰控股:2021年度净利润约3.05亿元 同比增加144.36%
-
日经225指数低开1.3%
-
上海好,是因为上海人好
-
朱少醒一季报:加仓药明康德、立讯精密、东方雨虹
-
舍得酒业2022年首季净利同比增逾7成 拟投70亿扩产将新增原酒6万吨/年
-
上交所向*ST昌鱼(600275.SH)发出监管工作函?公司股票存在退市风险
-
北向资金单日净买入9.11亿元,加仓电气设备、银行、医药生物
-
张坤最新持仓:增配美团五粮液 减持贵州茅台腾讯控股
-
养老金一季度新进哪些股票?
-
早间公告:和胜股份更正2021年度利润分配预案 拟10派2.02元
-
10000套特价房 恒大抢跑五一“黄金周”主推现房
-
南极电商:2021年净利润同比下降59.84% 拟10派0.8元
-
斯达半导:股东兴得利拟减持不超170.61万股
-
舍得酒业喜迎“开门红” 2022年一季度实现营收、净利润双增长
-
大华股份:公司以智慧物联终端设备生产为核心 在长沙建设了智能终端产品生产基地
-
生意社:4月21日伦敦LME锌锭夜盘行情
-
深市专精特新主题业绩说明会探讨创新发展
-
国药控股(01099)发布一季度业绩,归母净利润14.28亿元 同比增加17.41%
-
恒指牛熊街货比(55:45)︱4月22日
-
明星基金“开门迎客” 释放中长期入场信号
-
斯达半导:股东兴得利拟减持不超170.61万股
-
比依股份换手率31.18% 上榜营业部合计净买入932.26万元
-
长城汽车实力验证中国品牌向上
-
颗粒硅产业再现疑云:中来股份半道杀入 协鑫科技表示要提防技术外溢
-
宁德时代年报出炉:电池毛利率下滑 高瓴退出十大股东
-
“因家庭财产分割非交易过户” 隆基股份董事长“减”逾两成持股 还会减吗?
-
基金增减仓|生物股份:赵枫的睿远均衡价值三年持有混合A减仓
-
康华生物:第二、第五大股东分别计划减持不超4.18%、0.82%公司股份
-
科大讯飞:一季度净利同比跌超20% 2021盈利15.56亿元 拟10派1元
-
破发股铜冠铜箔跌4%创新低 超募22亿两券商合赚1.3亿
-
自损一千也无法伤“敌”八百!耶伦敦促欧洲谨慎对待俄罗斯能源禁令
-
2021年业绩再创新高 科大讯飞根据地业务占比超5成
-
*ST易见:公司股票可能被终止上市
-
一季度我国纺织服装出口创新高 16只概念股业绩翻倍
-
东方证券维持圣农发展买入评级
-
保租房全面实施 全装修成品交房
-
国风新材:公司在研光刻胶为光敏聚酰亚胺(PSPI)光刻胶
-
豪尔赛:一季度同比转亏 亏损2175.45万元
-
艾伯科技(02708)拟收购时领企业16.67%股权 锁定行业优质供应商资源
-
拉卡拉因与合作代理商产生服务合同纠纷遭列被执行人名录
-
市区新盘“千人摇”,远郊项目0登记,合肥楼市冷热不均,土地成交达峰值
-
国际天食(03666)将更名为“上海小南国”
-
利柏特签订3150万美元FPSO项目模块制造合同
-
会稽山:有关媒体相关文章内容严重脱离实际情形 纯属主观臆测
-
张坤最新持仓:增配美团五粮液 减持贵州茅台腾讯控股
-
铜陵有色2021年度净利同比增258% 拟10派1元
-
英搏尔收到VINFAST汽车开发定点通知书
-
振东制药龙虎榜:机构净买入1.25亿元
-
短期波动不改长期价值 上市公司要善用投关管理
-
动向|楼市等待“探底回升”,一季度末广州现转机
-
喆丽控股(02209.HK)授出23.75万份购股权
-
晚间利好有点熟悉的味道
-
中天顺联(00994)发布2021年业绩,股东应占亏损1.01亿港元,同比增加81.8%
-
喆丽控股(02209)授出合共出23.75万份购股权
-
养殖类上市公司“抢食”预制菜
-
澄而不清 华润双鹤新冠药传闻愈加扑朔迷离
-
艾伯科技(02708.HK)拟收购时领企业有限公司16.67%股权
-
江苏租赁:一季度净利同比增10.6%
-
时空科技:2022年第一季度净利润亏损1078.06万元 同比下降327.01%
-
拓新药业:2022年第一季度净利润约2844万元 同比下降5.57%
-
采纳股份股东户数连续4期下降 累计降幅29.34%
-
决战紫金之巅,这两个要素决定股市未来,注意,这样才能修复情绪
-
天风国际:减碳大势难逆 生物柴油赛道光华渐显
-
北京2022年第二批集中供地挂牌17宗地块 建筑规模同比降六成
-
今年来新房成交同比降七成 苏州各区域去化率分化明显
-
中国一重两项发明荣获中国专利优秀奖
-
光正眼科:2021年度净利润约4267万元 同比增加0.17%
-
国药控股(01099.HK)一季度归母净利14.28亿元 同比增长17.41%
-
国际天食(03666.HK)拟更名为“上海小南国”
-
传埃克森美孚(XOM.US)考虑在6月24日前全面撤出俄罗斯
-
知乎来了!即将登陆港交所 暗盘破发超20%!一年前美股上市 高位下跌近九成
-
舍得酒业首季净利增逾七成 拟投70亿扩产原酒
-
“券商一哥”遭罚!分公司两大违规 被责令整改!
-
ST辉丰:2021年度净利润约3.08亿元
-
康恩贝去年净利增长343% 14个品牌或产品销售过亿元
-
南方轴承:4月22日起证券简称变更为“南方精工”
-
打造医疗服务板块新业务 运盛医疗拟收购格伦菲尔口腔52%股权
-
扬杰科技:2021年净利润同比增长103% 拟10派2.2元
-
长江材料:公司有产品用于工程机械的零部件铸造 间接应用于基础建设
-
众合科技(000925.SZ)发布2021年业绩,净利润2.01亿元,同比增长255.54%,拟10派0.5元
-
精进电动(688280.SH)发布2021年业绩,净亏损4亿元
-
泰慕士:公司合作的客户有迪卡侬、森马服饰、全棉时代、太平鸟、安踏等
-
美股异动 | 氢能源板块下挫 普拉格能源(PLUG.US)跌超9%
-
钢研纳克2021年扣非净利润增长80% 积极推进全国布局
-
利柏特(605167.SH):签订3150万美元模块制造合同
-
广生堂(300436.SZ)发布2021年业绩 净亏损3488.66万元 同比由盈转亏
-
河钢股份(000709.SZ)发布2021年业绩 净利润26.88亿元 同比增58.32% 每10股派1元
-
天下秀董事长李檬:爆炸式增长的红人经济仍有较大提升空间
-
天风证券给予锦泓集团买入评级:TW收入同增38%快速增长 债务置换优化财务结构
-
隆基股份跌6.32% 华创证券招商证券在其高点唱多
-
嘉涛(香港)控股(02189.HK):潘启杰辞任非执行董事职务
-
北大资源(00618.HK)拟1亿元出售重庆鑫隆睿信息科技51%股权
-
新晋“白衣骑士”王健林,成色几何?
-
减持计划披露次日 富瀚微5%以上股东提前终止减持
-
三六零发布年报:实现营业收入约108.86亿元 安全业务增长超70%
-
跌麻了,毁灭吧!
-
中国铁建(01186):2022年可续期公司债券(第一期)品种一首个周期票面利率为3.17%
-
长江材料:集团母公司及部分子公司是当地认定的“专精特新”和“小巨人”企业
-
韫昊电器2021年亏损59.54万同比由盈转亏 营业成本增加
-
华电重工(601226.SH)发布2021年业绩,净利润3.03亿元,同比增长213.6%,拟10派0.85元
-
北向资金持续买入,益丰大药房业绩令人期待
-
森麒麟(002984.SZ)拟10股派1.7元 4月29日除权除息
-
美年健康:2021年度美年健康体检人数为1860万人次 平均客单价为520元
-
3万股民懵了!证监会出手:立案调查!更有退市风险
-
嘉涛(香港)控股(02189)附属与Global Crown订立改建及加建工程合约
-
新丰小吃2021年净利502.77万 较上年同期增长139.28%
-
硕达股份2021年净利18.52万同比扭亏为盈 项目收益增加
-
全球首富的魅力:十余家华尔街银行排队支持马斯克收购推特
-
三元股份(600429.SH)2021年液态奶营收约47.75亿元
-
浙罗托克2021年净利4.25万同比扭亏为盈 产品销售单价提高
-
众合科技(000925.SZ)拟斥资0.5亿元至1亿元回购股份
-
新技术行业数据:62.6%的用户期望输入法外观中的键盘皮肤更简洁
-
长江材料:公司的建筑彩砂和新型建材目前都处于研发试生产阶段
-
三六零(601360.SH)发布2021年业绩,净利润9.02亿元,下降69.02%,每10股派1元
-
雅本化学:公司在上海的职能部门目前全部居家办公
-
四川成渝高速公路(00107):蜀道投资4月21日增持441.2万股
-
舍得酒业拟斥资70亿增产扩能 一季度净利大增超70% 多家酒企扩产 啥信号?
-
美股异动 | 纽柯钢铁(NUE.N)涨超8% Q1每股收益超预期
-
元隆雅图2021年报:双主业协同发展稳步提升 创新型科技营销公司格局初显
-
河钢股份(000709.SZ)拟注册发行不超50亿元永续中期票据
-
外高桥(600648.SH):预计减免租金安排影响公司净利润约2.42亿元
-
明和股份2021年净利1170.18万同比下滑75.52% 部分原材料价格大幅上涨
-
海融科技(300915.SZ)发布2021年业绩,净利润1.12亿元,同比增长29.49%,每10股派4元
-
皓元医药(688131.SH)发布2021年度业绩,净利润1.91亿元,同比增长48.70%,每10股转增4股派5.30元
-
达沃环保2021年净利407.34万同比增长94.74% 乐山沙湾项目毛利率较高
-
因海岬型船运价走高 波罗的海运价指数创两周多以来新高
-
涨!涨!涨!猪肉价格反弹了!为什么?接下来怎么走
-
远大智能:近日公司与中国葛洲坝集团建设工程有限公司签订电梯战略采购合作协议,有效期2年
-
正通汽车(01728.HK)持有的东正金融股份将进行股权拍卖 明日复牌
-
金河生物(002688.SZ)拟回购1600万股至2667万股公司股份
-
紫金矿业获沪股通连续4日净买入 累计净买入6.73亿元
-
浙江建投:约2.49亿股限售股4月25日解禁 占比约23.0509%
-
泰莱电气2021年净利257.25万同比下滑56.62% 原材料价格上涨
-
瑞派尔2021年净利340.64万同比扭亏为盈 收回部分中长期应收账款
-
华之鹏2021年净利1428.27万同比增长96.41% 商品销售价格大幅上涨
-
核心产品毛利率下滑 熊猫乳品寻新增长点
-
宁德时代年报出炉:电池毛利率下滑 高瓴退出十大股东
-
正泽科技2021年净利469.67万同比增长16.39% 销售额增长
-
广州农商银行(01551)建议末期息每每10股1.05元
-
广生堂(300436.SZ)子公司广生中霖拟与瑞泰来签订《技术开发(合作)合同》
-
商络电子:280万股限售股4月25日解禁 占比0.67%
-
双成药业(002693.SZ):依替巴肽注射液sANDA获得美国FDA上市许可
-
中来股份半道杀入 协鑫科技表示要提防技术外溢
-
宁德时代2021年营业收入超1303亿元 同比增长159.06%
-
生意社:开工低位 市场动能松动 硫酸钾高位横盘
-
龙狮篮球2021年亏损1605万同比由盈转亏 人力成本增加
-
董事长悄悄减持?3000亿“光伏茅”紧急回应!光伏板块接连调整 后市怎么走?
-
数字化成果显现 居然之家2021年净利润同比增加71.36%
-
金河生物(002688.SZ)发布2021年度业绩,净利润9399.24万元,较上年同期减幅19.89%
-
香水行业数据分析:66.2%的白领购买香水送给朋友
-
东钢新材2021年净利614.92万同比下滑39.89% 主要原材料价格上涨
-
上海建工:一季度累计新签合同金额为1006.32亿元
-
随着大城市年轻人咖啡消费需求增加 中国2022咖啡进口或增5%
-
估值合理回归大幕开启 人民币汇率双向波动态势稳固
-
一汽解放荣获中国上市公司最佳投资者关系奖
-
东正金融(02718.HK):中国正通所持15.2亿股将被司法拍卖 明日复牌
-
宁德时代拿下宜春最大锂矿 产能或达20万吨碳酸锂/年 永兴材料或搭“便车”
-
四川成渝高速公路(00107.HK):控股股东拟增持不超公司2%股份 当日已增持441.2万股H股
-
东正金融(02718):中国正通持有的15.2亿股将进行司法拍卖 起拍价约16.068亿元 4月22日复牌
-
字节跳动“围剿”腾讯,网文IP的长期战略价值凸显
-
金能科技(603113.SH)拟向全资孙公司金能化学增资20亿元
-
商林科技2021年净利1402.48万同比下滑26.94% 出口业务量下降
-
创世达2021年净利89.63万同比下滑70.66% 营业成本增加
-
上海银行(601229.SH)发布2021年度业绩,净利润220.42亿元,同比增长5.54%,每10股派4元
-
北大资源(00618)拟约1亿元出售重庆鑫隆睿信息科技51%股权
-
新技术行业数据:手写功能中,自由手写功能使用比例达到80.8%
-
科力环保2021年亏损655.99万同比亏损增加 社保费用增加
-
金河生物(002688.SZ)拟新建产业链延伸年产1.5万吨高端赤藓糖醇项目
-
中国宝力科技(00164.HK)拟发行4000万港元可换股债券及转让深圳釨骏传媒20%股权
-
顾家家居2021年净利同比增长97% 拟10转3派13.2元
-
大豪科技:公司重大资产重组目前审核状态为“中止”
-
*ST丹邦涉嫌信披违规被立案
-
中盐化工一季度净利同比增长141%
-
振东制药:一季度净利914.99万元 同比减少90.63%
-
康恩贝:2021年营收利润双增长 扣非净利增长872.2%
-
隆基股份:董事长钟宝申本次持股变动原因为非交易过户 不存在窗口期违规减持和信息披露违规情形
-
东方国信:2021年度净利润约3.02亿元 同比增加0.04%
-
腾景科技股东拟合计减持不超5.43%股份
























































