康方生物(9926.HK)发布了2021年度业绩报告:公司成功实现首个自主创新药物安尼可(派安普利,PD-1单抗)上市销售,2021年产品销售额达2.12亿人民币。同时,公司授权给默沙东的CTLA-4单抗已经进入III期临床研究阶段,公司已收到相应的里程碑付款1.29亿人民币。
公司高效的研发投入,推动药物开发持续高速进展。在2021年度,在安尼可获批之外,公司成功递交包括卡度尼利(PD-1/CTLA-4双抗,AK104)在内的4个新药上市申请,全年共获得37项新药临床研究审批,2项创新性临床前项目进入临床阶段,研发效率为业内领先。截至报告期,公司共自主开发了超过30款创新生物药物公司,其中15个候选药物(含3个对外授权产品)处于临床阶段,共有15项临床研究处于注册性/III期临床研究阶段。报告期内,公司研发投入总计11.23亿人民币。
截至2021年底,各融资渠道现金总和总计逾50亿人民币,足以保障未来2年以上的研发支出。
康方生物创始人、董事长兼首席执行官夏瑜博士表示:“随着安尼可和卡度尼利等产品的陆续上市销售,公司已经开启了商业化的新征程,迈入了管线快速收获期,我们很高兴看到公司在商业化体系、研发体系和生产体系等领域建设均取得了跨越式发展。公司建设了自有的12款处于临床阶段产品的高价值管线,这将为后续我们新药持续上市销售,为企业长期高速稳定发展奠定坚实的基础。”
首款新药实现销售收入
多款重磅产品临近NDA
业绩报告披露,安尼可是公司首款实现商业化的创新药物,2021年8月批准用于治疗至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤(cHL)患者,上市后的4个余月内,共取得2.12亿人民币的销售收入。安尼可一线治疗鳞状治疗非小细胞肺癌(sq-NSCLC)和三线治疗鼻咽癌也分别于2021年7月和8月在中国提交上市申请,预期年内将获批上市。三线治疗鼻咽癌在美国也已经通过实时肿瘤评估新政于2021年9月递交BLA。
更值得关注的是,2021年内,康方生物2款完全自主创新的全球首创的PD-1双特异性抗体卡度尼利(PD-1/CTLA-4双抗,AK104)和AK112(PD-1/VEGF双抗)均取得重要突破。
其中,卡度尼利2/3L治疗复发/转移性宫颈癌已经在2021年9月成功在中国提交上市申请,并获得优先审评。此外,截至发稿,卡度尼利在2021年内已经将宫颈癌、胃癌、肝癌等癌种推进至关键/III期临床研究阶段。
康方生物自主研发的另几款核心产品也在2021年取得重大进展。AK112(PD-1/VEGF双抗)在2021年进入III期临床研究阶段,全面布局了各肺癌分型,其中治疗EGFR -TKI治疗进展的NSCLC,1L治疗驱动基因阴性的PD-L1阳性表达的NSCLC注册性/III期临床研究均已经启动。另外一款核心产品AK117(CD47)也已经领先在业内开展了针对实体瘤领域的各项联合用药研究,初步数据表现良好。
自免和代谢领域产品AK102(PCSK9单抗)、AK101(IL-12/IL-23单抗)也已经于2021年进入注册性/III期临床阶段,有望在不久的未来提交上市申请。
打造专业的深刻理解产品的商业化团队
基于目前诸多产品处于上市前夜,康方生物提前进行了商业化体系的建设。截至2021年底,已经初具成效和规模,团队成员超过500人,核心成员皆具有大品种营销的成功经验,商业化渠道上,团队实现了对全国1500+医院、 500+DTP药房、 60+保险机构的深度覆盖。
该专业化团队将负责核心双抗卡度尼利的商业化。基于卡度尼利在宫颈癌、胃癌、肝癌等疾病临床研究的良好疗效和先发优势,康方生物对卡度尼利未来的商业化信心十足。
高质量产业化体系建成
为了保障产品的商业化进程,公司同时加快了生产体系的建设。其中,康方生物中新广州知识城生物制药基地总规划符合GMP生产要求的60,000L产能基地项目一期顺利投产;康方湾区科技园正在高效建设中,规划符合GMP生产要求总产能达10万升。
展望未来,夏瑜博士指出,康方生物一是将策略性聚焦核心产品,加速核心管线的临床开发和上市申请进程,促进已提交上市申请产品的批准;二是持续强化商业化体系能力,提升已上市产品的商业化价值创造效率;三是继续以卡度尼利、AK112等核心双抗为基石开展联合用药,进一步挖掘在研管线的商业价值;四是紧随科学发展前沿,着重源头创新,不断开发具全球领先性的创新生物药物。
推荐内容
-

地产并购融资放松 首单房地产项目并购主题债券启动发行
-

贷款市场报价利率迎来调整 深圳房贷市场应声下调
-

央行下调LPR 新一期贷款市场报价利率(LPR)出炉
-

二级市场提振 复星医药、博瑞医药等相关个股大涨
-

消费股成为公募基金增持的主要方向 泸州老窖、贵州茅台获增持最多
-

家政服务企业保障人员供应 价格没有出现大的波动
-

多个城市培育建设国际消费中心城市 打造商业新增长极
-

春节外卖服务保供应 多措并举激励骑手留京过年
-

保险机构扩容潮逐渐消退 保险公司股权监管进一步强化
-

我国白开水赛道进一步扩大 农夫山泉加入战局
-

基本民生商品进入消费旺季 进一步抓实抓细市场保供
-

“隔离险”保费仅需9.9元 隔离1天补贴1000元可信吗?
-

知名啤酒厂商推出高端产品 上千元的啤酒你会买吗?
-

地方和企业抓住RCEP机遇 推动制造业和高端服务业融合发展
-

全年累计新增减税降费约1.1万亿元 政策红利持续释放
-

渝中区建立成渝地区双城经济圈 围绕国际一流营商环境打造
-

中国奢侈品消费潜力不断释放 海南免税购物进一步推动奢侈品消费
-

春节档票房逐年上升 11部影片“激战”2022年春节档
-

春节旅游消费依然呈现本地化 自驾游成主流出行方式
-

虎年金条热起来 一线城市的黄金饰品需求旺盛
-

董明珠新任期内提升空调业务效率 寻找格力第二增长曲线
-
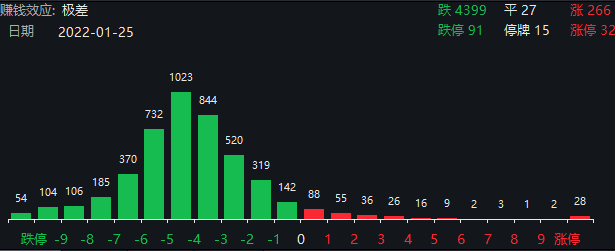
白酒概念、元宇宙、冰雪产业等多数概念股走弱
-

第三支柱个人养老金作为改革重点 持续创新商业模式
-

途虎养车年收入近年来不断攀升 16轮融资后开启IPO
-

韩国“菜篮子物价”创十年新高 食品类价格明显比往年高
-

多举措加强重点领域信用监管 依法依规实施联合惩戒
-

多地重大项目集中开工 投资规模力度明显加大
-

海南自贸港原辅料“零关税”增补清单落地 政策效应进一步扩大
-

消费重回经济增长第一动力地位 持续激发线上消费新活力
-

软件业务出口保持增长 从业人员规模不断扩大
-

北向资金持续看好 沪深两市成交额11290亿元
-

新一期贷款市场报价利率(LPR)公布 有助于提振房地产市场
-

睿远两基金仓位变化不大 持股以长期投资逻辑为主
-
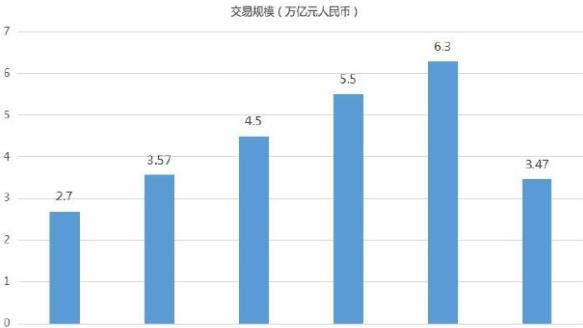
沪深两市低开震荡 收盘双双出现小幅回调
-

孩子王线下、线上面临经营困局 2021年业绩出现大幅下滑
-

国际油价创七年新高 期货价格18日收盘时均显著上涨
-

“食物银行”启用后即显萧条 引导更多餐饮企业和生鲜食品企业参与
-

新型冠状病毒核酸检测项目统一定价收费 不得收取“加急费”
-

到2025年地理标志认定数量保持稳定合理增长
-

冰雪旅游成为众多目的地冬季消费的新动能 南方的冰雪场馆越来越多
-

33家保险公司发布年度理赔报告 头部险企的总赔付金额有所增长
-

2021年末社会融资规模存量为314.13万亿元 同比增长10.3%
-

2022年物价或将延续温和上涨态势 仍将处在合理区间
-

新年要有仪式感 多品牌推出虎年限定款式
-

互联网保险新规落地 万能险、分红险成为历史
-

中石油、中石化、中海油三大公司组织好成品油生产
-

税务部门高效落实减税降费政策 为食品产业链发展添力
-

西宁综保区建成运行正式封关运行 构建双循环新发展格局
-

餐饮企业改进预订年夜饭的方式 半成品、预制菜成为“新宠”
-

植物奶市场近两年发展快速 即杏宣布完成千万元天使轮融资
-

我国知识产权人才规模达到69万人 全国50多所高校建立了学院
-

多地推出金融支持举措 纾困外贸企业发力稳外贸
-
巴西拟征收跨境税!多家电商平台中招
-

全球最大自贸协定稳步启航 多地抢抓RCEP机遇
-
隔夜利好,A股迎来反弹
-

RCEP生效即将满100天 成员国经贸发展的成效逐步显现
-

四川首单耕地地力指数保险落地 有机质含量增幅越大补偿越多
-
天房发展,股票交易异常波动公告+天津楼市房价上涨,热度回升,再不买真的就错过好时机了吗?
-

多家银行理财公司业绩报喜 净利润普遍实现较快增长
-
康方生物(9926.HK)2021年业绩:安尼可?销售开启商业化征程,全球首创双抗卡度尼利已提交上市申请
-
新能源汽车需要控制产能、突出技术
-
【上证指数研判】大阳线是不是调整结束了?
-

健康保险迎来政策利好 鼓励银行保险机构加强与政府部门合作
-
盘点多索茶碱市场:市场销售额超19亿,竞争日趋激烈
-

沪深两市高开高走 机构投资者买卖力度有所加大
-
生意社:3月31日中石化华南对二甲苯价格暂稳
-

机构踊跃申购固收产品 这些基金更受投资者青睐
-
国家药监局:明确部分医疗美容用产品按照医疗器械管理
-
生意社:3月31日中石化华东对二甲苯价格暂稳
-
马鞍山钢铁股份(00323.HK)建议于中国发行公司债券
-
高位板能不能随便打?
-
生意社:3月31日华南地区对二甲苯装置动态
-

明星基金经理公布年报:张坤加仓腾讯、海康威视
-
智通港股沽空统计|3月31日
-
美涂士连续八年蝉联500强首选供应商
-
生意社:3月31日中石化华北对二甲苯价格暂稳
-
深化“小巨人”企业“一企一策”检测服务—江苏金陵特种涂料有限公司
-

金时科技再遭大客户“抛弃” 存在着严重的大客户依赖
-
百瑞赢:战争退场后的情绪反扑能延续多久?
-
生意社:3月31日中石化华中对二甲苯价格暂稳
-

瑞士奢侈品牌Bally曾多次被监管处罚 在中国设有60家精品店
-
天涂大师仿石漆实力铸就辉煌,科研彰显实力
-
中信证券:房地产将迎来一个政策的窗口期,看好地产股的投资机会
-
生态环境部:我国医疗废物处置做到日产日清
-
拜登:若国会未能通过抗疫预算美国今秋将无法获得足够疫苗供应
-
数字王国(00547.HK):李卫强获委任为非执行董事
-
南药龙头猛攻创新药,5款1类新药已在路上
-
生意社:3月30日中质含硫原油交割仓库数量减少0
-

酒吧第一股海伦司上市首份年报 烧钱开店会加大杠杆风险
-
冲刺国产第2家 豪森药业酒石酸长春瑞滨软胶囊报产获受理
-

通威股份旗下公司发力绿色节能技术 获科技进步二等奖
-
中医药“十四五规划”出炉!15项发展指标,10项重点任务!
-
年报速递丨方圆生活2021年收益约5.7亿元 同比增加106.5%
-
多地已将新冠抗原检测试剂临时纳入医保!药店售卖应注意这些细节
-
年报速递|华润万象生活2021年股东应占溢利17.25亿元,同比增长110.9%
-
京喜从桥头堡沦为京东鸡肋:少搅局,做专做强比什么都好
-

房地产板块中有超过20股封死涨停板 市场中做多热情逐渐回复
-
康宁杰瑞制药-B(09966):KN046首个III期临床试验期中分析成功达到预设PFS终点
-
国家中医药局等10部门:到2025年社区卫生服务中心和乡镇卫生院中医馆实现全覆盖
-

贷款市场报价利率改革红利持续释放 货币政策传导效率增强
-
基石药业-B(02616.HK):潜在全球同类最佳药物CS5001(ROR1 ADC )I期临床在美国完成首例患者入组
-
思维播报|捞王赴港IPO,粤式火锅能否破局?
-
苹果公司也成网络安全受害者黑客伪装执法机构套取用户数据
-
中国海洋石油(00883)发盈喜 预期一季度归母净利240亿至280亿元,同比增长62%至89%
-
北京楼市“报复性回暖”:中介称“有客户一犹豫白工作一年”
-
又一省会城市限购松绑!未来放松限购城市数量或进一步增加
-
智通港股通资金流向统计(T+2)|3月31日
-
山东国信(01697)发布2021年业绩 股东应占利润4.68亿元 同比下滑25.4%
-
兴科蓉医药(06833.HK)年度纯利增加14.4%至1.35亿元
-
广发证券(01776.HK)拟斥资2.03亿至4.06亿元回购A股股份 回购价不超26.65元╱股
-
银城国际控股(01902.HK)2021年实现归母净利1.42亿元
-
中国银河(06881.HK):2021年归母净利104.3亿元 同比增长43.99%
-
天工国际(00826)发布天工股份2021年业绩 归母净利润2034.32万元 同比增长67.87%
-
中远海控(01919.HK)年度净利大增799.52%至892.96亿元 末期息0.87元
-
领悦服务集团(02165.HK)2021年纯利7520万元 同比增长7.0%
-
Waymo开始为旧金山员工提供无人驾驶服务以加快实现商业化进程
-
婚庆行业用户调研:超六成消费者对婚庆首饰/服装实用性感到不满
-
汇隆控股(08021.HK)授出不超7000万港元贷款融资
-
宠物行业:61.8%的消费者购买具有补钙功能的宠物食品
-
车载音乐行业:近七成的用户关注车载音乐内容种类的丰富度
-
海尔智家(06690.HK)2021年度纯利升47.1%至130.67亿元 拟10派4.6元
-
冠城钟表珠宝(00256.HK)2021年净亏收窄40.4%至1.01亿港元
-
新龙国际集团(00529.HK)2021年度业绩扭亏为盈至1.15亿港元 末期息2港仙
-
苹果公司也成网络安全受害者黑客伪装执法机构套取用户数据
-
官酝控股(08513.HK)2021年度权益持有人应占亏损705.2万坡元
-
上海谊众(688091.SH)发布2021年业绩,注射用紫杉醇聚合物胶束获批上市,实现营收407.75万元
-
思特沃克发布最新一期《技术雷达》:软件供应链创新成为商业焦点
-
飞沃科技2021年净利7820.23万同比下滑51.2% 利息支出增加
-
金力永磁(06680)2021年度利润分配预案:每10股派2.5元
-
弘阳地产:2021年归属股东核心净利润8.5亿元
-
宏桥高科(PBTS.US)智慧解决方案"慧眼智控"入选珠海市创新产品清单,成为政府采购首选
-
通银股份2021年净利58.31万同比下滑43.47% 服务合同已到期、未续签
-
固生堂(02273)OMO模式,疫情下的业绩保护伞:高增长、抗风险
-
财报难产,“裸泳”的房企要现形了?
-
大众公用(01635)委任魏伟峰为联席公司秘书、授权代表
-
安德利果汁(02218)拟开展远期结售汇业务 累计额不超1亿美元
-
桑尔管理2021年净利719.38万同比增长107.03% 外部结算费用同比下降
-
时代中国:2021年利润为人民币47.5亿元同比减幅为11.4%
-
全国股转公司、北交所出台优化服务新举措:免除2022年北交所上市年费
-
飞利富2021年净利349.23万同比增长107.44% 客户订单增加
-
浦林成山(1809.HK)营收逆势增涨,创新发展蓄势成长新动能
-
3.30复盘,明日操作策略:
-
龙源电力(00916.HK)2021年净利润增长27.6%至64.13亿元 每股派0.147元
-
新龙脉基金王雨荍:从“对抗”转向“合作”的硬科技投资猎手
-
快手-W(01024.HK)授出1623.998万份购股权
-
雅迪控股(01585.HK)获控股股东增持180万股
-
外资百亿抄底,A股迎久违的反弹。
-
直播卖货再度受宠于二三线家电品牌
-
美凯龙:2021年归属股东净利润20.47亿元同比增18.31%
-
德信中国(02019.HK)最近回购460万美元2022年票据
-
有赞CEO白鸦内部信:奔向人均50万年度目标,一起实现正向现金流
-
瑞德智能(301135.SZ)网上定价发行中签率为0.0186%
-
凯莱英(002821.SZ)发布2021年业绩,净利润10.69亿元,同比增长48.08%,每10股派8元转4股
-
沈信股份2021年亏损732.02万同比由盈转亏 总体毛利率下降
-
羽实箫恩2021年净利795.78万同比增长71.86% 核心银行业务需求增加
-
万科A:2021年归属股东净利润225.2亿元
-
广州金航2021年亏损237.86万同比亏损增加 成本费用增加
-
万科A(000002.SZ)发布2021年业绩,净利润225亿元,下降45.7%,每10股派9.70元
-
康乾大成2021年净利633.29万同比增长363.43% 管理费用减少
-
中梁控股:2021年归属股东核心净利润29.9亿元
-
华侨城A:2021年归属股东净利润38亿元
-
智莱科技(300771.SZ)发布2021年业绩,净利润1.69亿元,同比下降29.36%,每10股转增5股派3元
-
福州放松限购:非户籍家庭可在当地购房,年内超60城出台稳楼市政策
-
飞凯材料(300398.SZ)发预盈,预计一季度净利润1.23亿元-1.43亿元,同比增长80%-110%
-
梅力更2021年亏损20.63万同比亏损减少 毛利率大幅增加
-
双星新材(002585.SZ)一季度净利预增25%-35%
-
南京熊猫(600775.SH)发布2021年业绩,净利润4193万元,同比下降45.77%,拟10派0.14元
-
流金岁月2021年净利润7593万元:拟派现3090万元 连续第四年派现
-
又一个二线城市放松限购!福州“松绑”对楼市影响几何?
-
价升量增,后市看高一线
-
用友YonSuite全场景SaaS服务让天堑变通途
-
盘龙药业(002864.SZ)监事何俊亲属在窗口期买卖公司股票、短线交易
-
暗盘情报|力高健康生活收涨10.98%,每手赚225港元
-
重庆钢铁(601005.SH)发布2021年业绩,净利润22.74亿元,同比增长256.22%
-
中国中车(01766)2021年度利润分配方案:每10股派1.8元
-
央企带头减免房租,谁能受益?
-
优信2022财年第三季度交易量大涨111%,消费者净推荐值再创新高
-
讯众股份提交北交所辅导备案材料 去年前三季度净利4941万元增长18%
-
中国铁建:2021年净利润293.152亿元同比增长14.03%
-
太疯狂!这个省会城市,放开限购了
-
达丰设备(02153.HK):郭金君获委任为非执行董事
-
宝宝树高敏:共创业再出发让全球母婴家庭共享美好生命旅程
-
陈琦|上海一家人的“抢菜大战”,关键时期离不开互联网巨头们
-
西陇科学跨界收购实控人亲属亏损锂电资产 频繁买卖资产反复套利?
-
新疆同济堂所持1050万股权被冻结
-
大唐集团控股:2021年归属股东净利润7.26亿元同比略有增长
-
快意电梯(002774.SZ)业绩快报:2021年度扣非净利润升93.40%至2228.25万元
-
绿亨科技2021年净利6269.59万同比增长15.05% 不断优化产品、拓展市场
-
电魂网络(603258.SH)发布2021年业绩,净利润3.39亿元,同比减少14.19%,每10股派8.25元
-
博俊科技(300926.SZ)发布2021年业绩,净利润8422.58万元,增长25.15%,每10股派1.2元
-
德源药业去年净利润7789万元:糖尿病药收入稳增24% 高血压药收入大增169%
-
临涣水务2021年净利2728.07万同比下滑22.28% 销售量下降
-
2021年财报发了,但小鹏还不能松口气
-
润农节水2021年营收同比增长14.6%:积极拓展新市场 成效显著
-
中老铁路助力老挝木材进入国内市场
-
临沂兰山加速木业全产业链整体提升
-
美登科技创业板转战北交所:主营电子商务第三方软件服务 去年净利4836万元
-
农行来宾象州县支行助力林木产业“稳”中向前
-
马钢股份(600808.SH):拟发行不超100亿元公司债券
-
【0330决策致胜】多点开花大反弹,后市方向在哪里?
-
大盘量化分析3月30日
-
国家统计局公布!这些行业利润同比增长翻倍
-
ST贵人(603555.SH):2021年度业绩扭亏为盈至3.61亿元
-
外资罕见抄底127亿元,第二波反弹即将开启?
-
晨日科技2021年净利1512.41万同比增长173.39% 市场开拓持续产生订单
-
2021年数字经济服务质量满意度同比增长2.6%
-
振华重工(600320.SH)业绩快报:2021年度净利升4.17%至4.40亿元
-
奇石缘2021年净利2084.66万同比下滑8.83% 财务费用增加
-
青岛港(601298.SH)发布2021年业绩,净利润39.64亿元,同比增长3.18%,每10股派2.564元
-
银信农贷2021年净利719.75万同比下滑45.49% 业务及管理费用同比增加
-
3.30股评:主线大涨,结构没变!但是,涨跌逻辑发生根本性改变!
-
和晶科技拟购和晶智能剩余31.08%股权同时定增5000万元配套资金
-
达瑞生物2021年亏损1516.28万同比由盈转亏 投资收益减少
-
安彩高科(600207.SH):拟3.8亿元投建中性硼硅药用玻璃项目
-
多家原材料巨头,宣布提价
-
多家原材料巨头,宣布提价
-
社区营造,让社区居民成为主角
-
城投鹏基2021年净利1146.6万同比增长110.2% 增加劳务派遣及物业服务项目
-
耀皮玻璃(600819.SH)2021年拟计提资产减值准备1.07亿元
-

温州市区部分商场和沿街店铺排队未设一米线
-
中闽能源(600163.SH)发预盈,预计一季度净利润2.62亿元到3.14亿元,同比增加51%到81%
-

鹿城公安启动流动人口基础攻坚行动 形成流动人口服务管理闭环
-
重点建设名单,两橡胶助剂项目列入!
-
中国主导ISO标准,发布!
-

机械强农为温州全市春耕备耕农业生产按下“加速键”
-
全国表彰公示,福建橡企2人获推荐!
-
日新快讯|碧桂园服务肖华:天力物业将聚焦高端商写物业增值服务
-

温州港5座5万至10万吨级码头集中开工 总投资33亿元
-
宝宝树集团(1761.HK)2021年业绩交流会实录
-
山西重点项目名单,两炭黑项目列入
-
金浦钛业(000545.SZ)拟以约1.47亿元向控股股东购买南京鼓楼区相关房产 作为总部大厦
-
重要通知:“中橡协十届二次理事会、三次常务理事会暨第十七届中国橡胶年会”延期举办
-
新行情要开始了,把握机会!
-

吉林省内各兄弟市州全力驰援长春 1000吨左右“蔬菜包”直达长春
-
【2021回顾】木门行业多维度突破再“升级”!
-
绿景中国:2021年归属股东净利润11.52亿元,同比减少66.62%
-
远大住工:2021年归属股东净利润3242万元
-
轮胎海外仓项目,签约!
-
重点建设名单,两橡胶助剂项目列入!
-
高性能轿车胎产业化项目,拟提名一等奖!
-
全国表彰公示,福建橡企2人获推荐!
-
轮胎公司重大并购敲定,价值147亿元!
-
关于中国橡胶工业协会2022年度“诚信橡胶产业服务商”、 “诚信橡胶贸易商”拟推介名单公示
-
关于开展行业实验室间比对试验的通知
-
张立群院士任组长,产业化项目通过评价
-
阿朗新科(常州),EPDM增量15%!
-

上海市消保委公布消费者权益保护领域问题
-
全国表彰公示,一集体一个人被推荐!
-
【竞猜有奖】周四中交地产能否7天6板?
-
耀皮玻璃(600819.SH)拟设立子公司以投建一条先进的四银镀膜生产线







































































